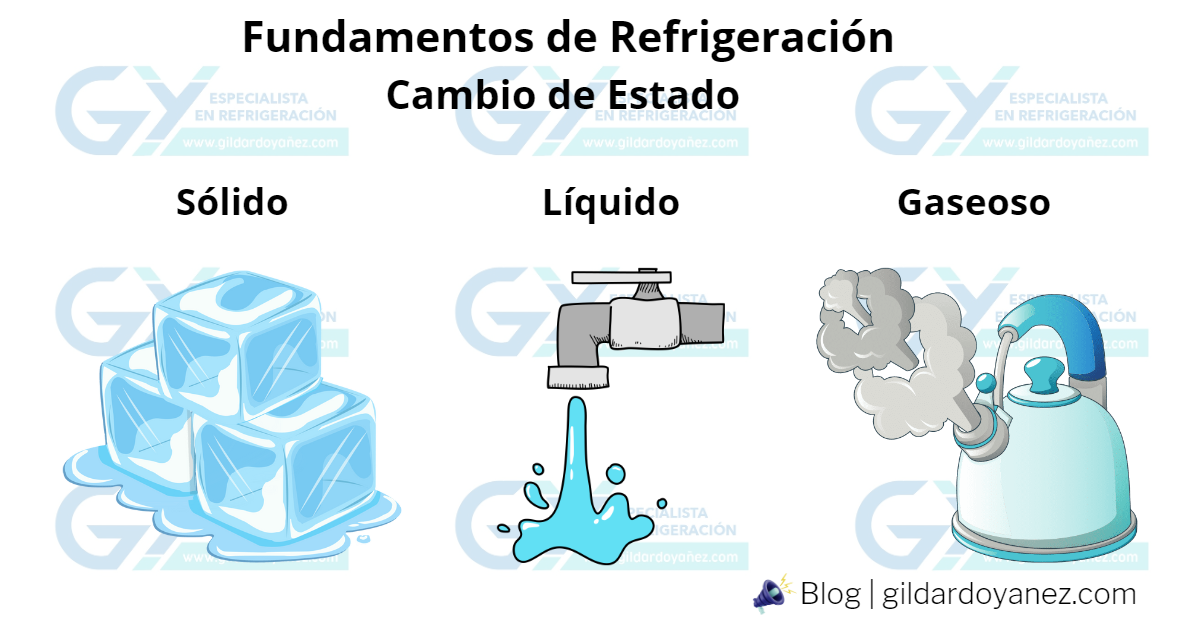
22 Abr Cambio de estado
La mayoría de las sustancias pueden existir en estado sólido, líquido o gaseoso, dependiendo de su temperatura y presión a la que se encuentren expuestas.
El calor puede cambiar la temperatura, y el estado de las sustancias. También puede ser absorbido aun cuando no exista cambio de temperatura. Como cuando sólido cambia a líquido, o cuando el líquido se transforma en vapor. Cuando el vapor se vuelve líquido, o cuando el líquido vuelve a transformarse en sólido, se despide la misma cantidad de calor.
El ejemplo más común de este proceso es el agua, que existe como líquido, que puede existir como sólido en forma de hielo y como gas cuando se convierte en vapor. A nivel del mar, si el agua llega a una temperatura de 0°C (32°F) y cede el suficiente calor, comienza a congelarse para convertirse en hielo. De forma inversa, el hielo puede incrementar su temperatura hasta alcanzar los 0°C, absorbiendo calor a temperatura constante mientras se derrite y se vuelve agua nuevamente. Si el agua continúa aumentando su temperatura, puede alcanzar su temperatura de ebullición de 100°C (212°F) a nivel del mar, en este punto comenzará a evaporarse. Sin importar la cantidad de calor aplicado, la temperatura no puede subir más de 100°C (212°F).
Mientras el agua siga siendo líquida y si el vapor pudiera ser retenido en el recipiente evitando la ebullición y se continuara agregando calor, entonces la temperatura podría nuevamente aumentarse. Cuando el vapor se condensa nuevamente formando agua, despide exactamente la misma cantidad de calor que absorbió al evaporarse. Si el agua se congela, debe extraerse la misma cantidad de calor que absorbió en el proceso de congelamiento por medio de algún proceso para causar la congelación.

